Acides, bases et pH
Sécurité

Les acides et les bases sont des solutions aqueuses corrosives. On les repère avec le pictogramme « ça ronge ».
On doit mettre des lunettes de protection et parfois des gants.
Attention les acides sont très irritants avec la conjonctive de l’œil. Mais les bases réagissent de manière pire encore avec la conjonctive de l’œil.
Attention Les acides et les bases réagissent vivement avec la peau et les muqueuses. En particulier, Les bases comme la solution aqueuse d'hydroxyde de sodium, appelée "soude", sont très corrosives. Elles rongent très vite la conjonctive de l’œil.
Ne vous frottez pas les yeux lors des expériences. Lavez-vous les mains en sortant de la salle avec du savon (paillasse du professeur).
Portez des lunettes de protection tout au long des expériences jusqu'à ce que vous ayez éliminés toutes les substances.
En cas de problème, ne paniquez pas et informez rapidement le professeur.
Utilisez ensuite le flacon rince-oeil présent vers le lavabo de la paillasse du professeur.
Le pH
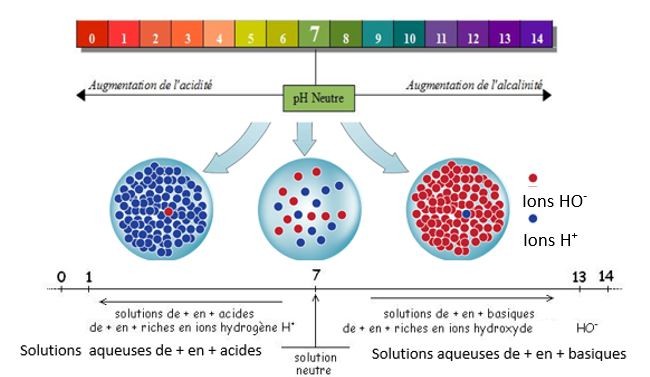
Le pH est une grandeur sans unité qui caractérise la corrosivité d’un acide ou d’une base :

Plus on s'éloigne de 7, que ce soit en diminuant (vers 0) ou en augmentant (vers 14), plus l'acide ou la base est corrosive et dangereuse.
On mesure le pH d’une solution aqueuse à l’aide d’un pH-mètre ou d’un papier pH.
Les solutions neutres
de pH = 7 ne sont pas corrosives car ni acides, ni basiques. L'eau pure a un pH de 7.
NB: Comme on parle d'acidité pour un acide, on parle de basicité ou d'alcalinité pour une base.
Pour mesurer le pH
d'une solution aqueuse, on peut utiliser du papier-pH et son échelle de teinte ou un pH-mètre.

La vidéo ci-dessous présente un indicateur coloré de pH. le bleu de bromothymol.

La vidéo ci-dessous présente la méthode de mesure de pH grâce au papier-pH

Les ions responsables de acidité ou de la basicité
L’acidité d’une solution aqueuse est due aux ions hydrogène H+ (ou ions hydronium H3O+). Le caractère basique (= basicité ou alcalinité) d’une solution aqueuse est dû aux ions hydroxyde HO-.
Plus une solution est concentrée en ions hydrogène H+ , plus le pH diminue et s'éloigne de 7,et plus l'acide est corrosif.
Plus une solution est concentrée en ions hydroxyde HO-, plus
le pH augmente et s'éloigne de 7,et plus la base est corrosive.
A l'inverse:
Si on dilue un acide, son pH augmente et se rapproche de 7.
Si on dilue une base, son pH diminue et se rapproche de 7.
Complément
Le jus de chou rouge
La vidéo ci-contre présente la fabrication et l'utilisation d'un autre indicateur coloré : le jus de rouge rouge.

Complément
Dans cette simulation, vous pourrez mesurer le pH de certains liquides et les mélanger







